.
Dengan berat hanya sekitar 150 gram atau sebesar kira-kira separuh
genggaman tangan kita, ginjal memiliki fungsi sangat strategis dalam
mempengaruhi kinerja semua bagian tubuh. Selain mengatur keseimbangan
cairan tubuh, eletrolit, dan asam basa, ginjal juga akan membuang sisa
metabolisme yang akan meracuni tubuh, mengatur tekanan darah dan menjaga
kesehatan tulang.
disebut kronik jika kerusakannya sudah terjadi selama lebih dari tiga
bulan dan lewat pemeriksaan terbukti adanya kelainan struktur atau
fungsi ginjal.
kronik terjadi penurunan fungsi ginjal secara perlahan sehingga terjadi
gagal ginjal yang merupakan stadium terberat penyakit ginjal kronik.
Jika sudah sampai stadium ini, pasien memerlukan terapi pengganti ginjal
berupa cuci darah (hemodialisis) atau cangkok ginjal yang biayanya
mahal.
sering tanpa keluhan sama sekali, bahkan tak sedikit penderita mengalami
penurunan fungsi ginjal hingga 90 persen tanpa didahului keluhan. Oleh
karena itu, pasien sebaiknya waspada jika mengalami gejala-gejala
seperti,
.
memang bukan penyakit menular, setiap orang dapat terkena penyakit
ginjal, namun mereka yang memiliki faktor risiko tinggi seperti mereka
yang memiliki riwayat
, serta ada anggota keluarga yang dinyatakan dokter sakit
ginjal sebaiknya melakukan pemeriksaan dini.
Ada beberapa jenis pemeriksaan yang bisa dilakukan untuk mengetahui
kesehatan ginjal, salah satunya yang paling umum adalah pemeriksaan
urin. Jika ada kandungan protein atau darah dalam air kencing tersebut,
maka menunjukkan kelainan dari ginjal.
Atau bisa juga melakukan pemeriksaan darah guna mengukur kadar
kreatinin dan urea dalam darah. Jika kadar kedua zat itu meningkat,
menunjukan gejala kelainan ginjal. Sementara pemeriksaan tahap lanjut
untuk mengenali kelainan ginjal berupa pemeriksaan radiologis dan biopsi
ginjal. Biasanya pemeriksaan ini atas indikasi tertentu dan sesuai
saran dokter.
Gangguan ginjal bisa dicegah dengan berbagai cara, terutama dengan
menerapkan gaya hidup sehat. Berhenti
,
memperhatikan kadar kolesterol, kendalikan berat badan, menghindari
kekurangan cairan dengan cukup minum air putih tidak lebih dari 2 liter
setiap hari. “Minum air secara berlebihan justru akan merusak ginjal,”
kata Dr.David Manuputty, SpBU dari RSCM Jakarta.
Selain gaya hidup sehat, lakukan pemeriksaan kesehatan tahunan pada
dokter, mintalah pula agar urin Anda diperiksa untuk melihat adanya
darah atau protein dalam urin. Yang tak kalah penting, berhati-hatilah
dalam menggunakan obat anti nyeri khususnya jenis obat anti inflamasi
non steroid.
Rasa nikmat dan lezat dari setiap makanan yang
dirasakan dipengaruhi oleh adanya rangsangan pada lidah. Ungkapan rasa
sakit seperti mengucapkan kata “aduh” juga terkait rangsangan pada
bagian tertentu tubuh kita. Oleh karena itu,
diartikan sebagai segala sesuatu yang menyebabkan
perubahan pada tubuh atau bagian tubuh tertentu. Sedangkan alat tubuh
yang menerima rangsa ng an tersebut dinamakan
.
Adanya reseptor, memungkinkan rangsangan dihantarkan menuju sistem
saraf pusat. Di dalam saraf pusat, rangsangan akan diolah untuk dikirim
kembali menuju efektor, seperti otot dan tulang oleh suatu sel saraf
sehingga terjadi tanggapan (respons).
Sementara itu, rangsangan yang menuju tubuh dapat berasal dari bau,
rasa (seperti pahit, manis, asam, dan asin), sentuhan, cahaya, suhu,
tekanan, dan gaya berat. Rangsang an semacam ini akan diterima oleh
indra penerima yang disebut
.
Sedangkan rangsangan yang berasal dari dalam tubuh misalnya rasa
lapar, kenyang, nyeri, maupun kelelahan akan diterima oleh indra yang
dinamakan
. Tentu semua
rangsangan ini dapat kita rasakan karena pada tubuh kita terdapat
sel-sel reseptor.
. Setiap neuron
tersusun atas badan sel, dendrit, dan akson (neurit).
merupakan bagian sel saraf yang mengandung
nukleus (inti sel) dan tersusun pula sitoplasma yang bergranuler dengan
warna kelabu. Di dalamnya juga terdapat membran sel, nukleolus (anak
inti sel), dan retikulum endoplasma. Retikulum endoplasma tersebut
memiliki struktur berkelompok yang disebut
.
Pada badan sel terdapat bagian yang berupa serabut de ngan penjuluran
pendek. Bagian ini disebut
. Dendrit memiliki
struktur yang bercabang-cabang (seperti pohon) dengan berbagai bentuk
dan ukuran. Fungsi dendrit adalah menerima impuls (rangsang) yang datang
dari reseptor. Kemudian impuls tersebut dibawa menuju ke badan sel
saraf. Selain itu, pada badan sel juga terdapat penjuluran panjang dan
kebanyakan tidak bercabang. Namanya adalah
.
Akson berperan dalam menghantarkan impuls dari badan sel menuju
efektor, seperti otot dan kelenjar. Walaupun diameter akson hanya
beberapa mikrometer, namun panjangnya bisa mencapai 1 hingga 2 meter.
Supaya informasi atau impuls yang dibawa tidak bocor
(sebagaiisolator), akson dilindungi oleh selubung lemak yang kemilau.
Kita bisa menyebutnya
. Selubung mielin
dikelilingi oleh
. Selubung mielin
tersebut dihasilkan oleh selsel pendukung yang disebut
.
Sementara itu, pada akson terdapat bagian yang tidak terlindungi oleh
selubung mielin. Bagian ini disebut
, yang
berfungsi memperbanyak impuls saraf atau mempercepat jalannya impuls.
Berdasarkan struktur dan fungsinya, neuron dikelompokkan dalam tiga
bagian, yaitu neuron sensorik, neuron motorik, dan interneuron.
(jamak = ganglia). Dendritnya berhubungan dengan neurit neuron
lain, sedangkan neuritnya berkaitan dengan dendrit neuron lain. Fungsi
neuron sensorik yakni meneruskan impuls (rangsangan) dari reseptor
menuju sistem saraf pusat (otak dan sumsum tulang belakang). Oleh karena
itu, neuron sensorik disebut pula
.
merupakan neuron yang
berperan meneruskan impuls dari sistem saraf pusat ke otot dan kelenjar
yang akan melakukan respon tubuh. Karena perannya ini, neuron motorik
disebut pula
. Dendrit neuron motorik
berhubungan dengan neurit neuron lain, adapun neuritnya berkaitan dengan
efektor (otot dan kelenjar).
dengan letak yang berada
pada otak dan sumsum tulang belakang. Interneuron merupakan neuron yang
membawa impuls dari sensorik atau interneuron lain. Karena itu,
interneuron disebut pula
.
Sel-sel saraf bekerja secara kimiawi. Sel saraf
yang sedang tidak aktif mempunyai potensial listrik yang disebut
potensial istirahat. Jika ada rangsang, misalnya sentuhan, potensial
istirahat berubah menjadi potensial aksi. Potensial aksi merambat dalam
bentuk arus listrik yang disebut
yang merambat dari sel
saraf ke sel saraf berikutnya sampai ke pusat saraf atau sebaliknya.
Jadi, impuls adalah arus listrik yang timbul akibat adanya rangsang.
Dalam pelaksanaannya, sel-sel saraf bekerja
bersama-sama. Pada saat datang rangsang, impuls mengalir dari satu sel
saraf ke sel saraf penghubung, sampai ke pusat saraf atau sebaliknya
dari pusat saraf ke sel saraf terus ke efektor. Hubungan antara dua sel
saraf disebut sinapsis.
Ujung neurit bercabang-cabang, dan ujung cabang yang berhubungan
dengan sel saraf lain membesar disebut bongkol sinaps (knob). Pada
hubungan dua sel saraf yang disebut sinaps tersebut, dilaksanakan dengan
melekatnya neurit dengan dendrit atau dinding sel. Jika impuls sampai
ke bongkol sinaps pada bongkol sinaps akan disintesis zat penghubung
atau neurotransmiter, misalnya zat
Dengan zat transmiter inilah akan terjadi potensial aksi pada
dendrite yang berubah menjadi impuls pada sel saraf yang dihubunginya.
Setelah itu, asetilkolin akan segera tidak aktif karena diuraikan oleh
enzim
menjadi asetat dan kolin.
Seperti halnya jaringan komputer, sistem saraf
mengirimkan sinyalsinyal listrik yang sangat kecil dan bolak-balik,
dengan membawa informasi dari satu bagian tubuh ke bagian tubuh yang
lain. Sinyal listrik tersebut dinamakan
).
Ada dua cara yang dilakukan neuron sensorik untuk menghantarkan impuls
tersebut, yakni melalui membran sel atau membran plasma dan sinapsis.
Di dalam neuron, sebenarnya terdapat membran plasma yang sifatnya
semipermeabel. Membran plasma neuron tersebut berfungsimelindungi cairan
sitoplasma yang berada di dalamnya. Hanya ion-ion tertentu akan dapat
bertranspor aktif melewati membran plasma
menuju membran plasma neuron lain.
Apabila tidak terdapat rangsangan atau neuron dalam keadaan
istirahat, sitoplasma di dalam membran plasma bermuatan listrik negatif,
sedangkan cairan di luar membran bermuatan positif. Keadaan yang
demikian dinamakan
. Perbedaan muatan ini terjadi karena adanya mekanisme
transpor aktif yakni pompa natrium-kalium. Konsentrasi ion natrium
(Na+) di luar membrane plasma dari suatu akson neuron lebih tinggi
dibandingkan konsentrasi di dalamnya. Sebaliknya, konsentrasi ion kalium
(K+) di dalamnya lebih besar daripada di luar. Akibatnya, mekanisme
transpor aktif terjadi pada membran plasma.
Kemudian, apabila neuron dirangsang dengan kuat, permeabilitas
membran plasma terhadap ion Na+ berubah meningkat. Peningkatan
permeabilitas membran ini menjadikan ion Na+ berdifusi ke dalam membran,
sehingga muatan sitoplasma berubah menjadi positif. Fase seperti ini
dinamakan
.
Sementara itu, ion K+ akan segera berdifusi keluar melewati membrane
Fase ini dinamakan
. Perbedaan muatan pada
bagian yang mengalami polarisasi dan depolarisasi akan menimbulkan arus
listrik.
Nah, kondisi depolarisasi ini akan berlangsung secara terus-menerus,
sehingga menyebabkan arus listrik. Dengan demikian,
akan terhantar sepanjang akson. Setelah impuls terhantar,
bagian yang mengalami depolarisasi akan meng alami fase istirahat
kembali dan tidak ada impuls yang lewat. Waktu pemulihan ini dinamakan
.
1. Sistem Saraf Pusat
Tanpa sistem saraf pusat, kemungkinan kita menjadi makhluk yang tak
berdaya dan tidak bisa melakukan apapun. Sebab, di dalam sistem saraf
pusat tubuh kita terdiri atas otak dan sumsum tulang belakang. Dua
bagian tubuh inilah yang menjadi sentral pusat koordinasi tubuh kita.
Pada manusia, otak dan sumsum tulang belakang dilindungi oleh suatu
tulang. Tulang yang melindungi otak adalah tulang tengkorak, sedangkan
sumsum tulang belakang dilindungi oleh ruas-ruas tulang belakang. Kedua
organ penting ini juga dilindungi oleh suatu lapisan pembungkus yang
tersusun dari jaringan pengikat. Lapisan ini disebut
.
. Cairannya dinamakan
. Fungsi cairan ini adalah sebagai bantalan yang
meredam guncangan saat terjadi benturan pada otak dan sumsum tulang
belakang. Di dalam otak dapat terjadi benturan misalnya antara otak
dengan tulang kepala. Sedangkan pada sumsum tulang belakang, benturan
yang terjadi antara sumsum tulang belakang dengan tulang belakang.
Otak merupakan benda lengket yang lunak, bermi nyak, dan kenyal.
Jutaan saraf menghubungkannya dengan seluruh tubuh, syaraf tersebut
membawa pesan baik menuju otak atau dari otak. Beratnya sekitar 1,6 kg
pada laki-laki dan 1,45 kg pada perempuan. Perbedaan ini terjadi
semata-mata karena bentuk otak laki-laki yang lebih besar dan berat.
Sementara, berat ini tidak terkait dengan kecerdasan seseorang. Namun,
banyaknya jumlah hubungan sel dalam otaklah yang menunjukkan kecerdasan.
Otak manusia terdiri atas dua belahan (hemisfer) yang besar, yakni
belahan kiri dan belahan kanan. Oleh karena terjadi pindah silang pada
tali spinal, belahan otak kiri mengendalikan sistem bagian kanan tubuh,
sebaliknya belahan kanan mengendalikan sistem bagian kiri tubuh. Tali
spinal (sumsum tulang belakang) merupakan tali putih kemilau yang
berasal dari dasar otak hingga tulang belakang.
Saat masih embrio, otak manusia terdapat tiga bagian yaitu otak
depan, otak tengah, dan otak belakang. Setelah dewasa, otak depannya
terbagi menjadi telensefalon dan diensefalon. Sementara, otak
belakangnya terbagi menjadi metensefalon dan mielensefalon. Bagian
dorsal metensefalon membentuk serebelum, sedangkan mielensefalon menjadi
medula oblongata.
Antara bagian tengah sumsum tulang belakang dan otak terdapat saluran
yang saling berhubungan, yang disebut
.
Ventrikel membagi otak menjadi empat ruangan. Di dalam ventrikel,
terdapat cairan serebrospinal yang dapat bertukar bahan dengan darah
dari pembuluh kapiler pada otak.
).
Serebrum ini terbagi menjadi belahan (hemisfer) serebrum kanan dan
kiri. Permukaan luar serebrum (
)
berwarna abu-abu karena mengandung banyak badan sel saraf. Selain itu,
pada bagian dalam (medula) otak depan terdapat lapisan yang berwarna
putih, karena mengandung dendrit dan akson.
Korteks serebrum berkaitan dengan sinyal saraf ke dan dari berbagai
bagian tubuh. Karenanya, pada korteks serebrum terdapat
yang menerima impuls dari reseptor pada indra. Di
samping itu, bagian tersebut terdapat juga
yang
mengirimkan perintah pada efektor. Selain itu, terdapat terdapat
yang menghubungkan area motorik dan sensorik serta
berperan dalam berbagai aktivitas misalnya berpikir, menyimpan
ingatan, dan membuat keputusan.
(bagian antara depan-belakang).
Pada bagian kepala manusia, lobus frontalis berada pada bagian dahi;
lobus temporalis berada pada bagian pelipis; lobus oksipitalis berada
pada bagian belakang kepala; dan lobus parietalis berada pada bagian
ubun-ubun.
Lobus-lobus ini memiliki fungsi yang beragam. Lobus frontalis
berfungsi sebagai pusat berpikir; lobus temporalis sebagai pusat
pendengaran dan berbahasa; lobus oksipitalis sebagai pusat penglihatan;
dan lobus parietalis sebagai pusat sentuhan dan gerakan.
Otak depan juga mencakup bagian-bagian yang lain, seperti talamus,
hipotalamus, kelenjar pituitari, dan kelenjar pineal.Sebelum diterima
area sensorik serebrum, semua rangsangan akan diproses terlebih dahulu
oleh
. Hanya rangsangan penciuman saja yang
tidak diterima oleh talamus tersebut. Sedangkan fungsi talamus yang lain
misalnya mengatur suhu dan kandungan air dalam darah, kemudian juga
mengkoordinasi aktivitas yang terkait emosi.
merupakan bagian yang berfungsi mengatur
suhu tubuh, selera makan, dan tingkah laku. Selain itu, hipotalamus
juga mengontrol
, yakni kelenjar
hormon yang berperan dalam mengontrol kelenjar-kelenjar homon lainya,
seperti kelenjar tiroid, kelenjar adrenalin, dan pankreas.
Otak tengah manusia berbentuk kecil dan tidak terlalu mencolok. Di
dalam otak tengah terdapat bagian-bagian seperti lobus optik yang
mengatur gerak bola mata dan kolikulus inferior yang mengatur
pendengaran. Otak tengah berfungsi menyampaikan impuls antara otak depan
dan otak belakang, kemudian antara otak depan dan mata.
Otak belakang manusia tersusun atas dua bagian utama yakni otak kecil
(serebelum) dan medula oblongata.
adalah
bagian yang berkerut di bagian belakang otak, dan terdiri atas dua.
belahan yang berliku-liku sangat dalam. Fungsinya adalah sebagai pusat
keseimbangan dalam tubuh, koordinasi motorik/gerakan otot, dan memantau
kedudukan posisi tubuh. Adanya serebelum memungkinkan kita belajar
gerakan yang terlatih dan saksama, seperti menulis atau bermain musik
tanpa berpikir.
Di antara kedua belahan serebelum terdapat suatu bagian yang berisi
serabut saraf. Bagian tersebut dinamakan
. Fungsinya ialah menghantarkan impuls dari
bagian kiri dan kanan otak kecil. Selain itu, jembatan varol juga
menghubungkan korteks otak besar dengan otak kecil, dan antara otak
depan dengan sumsum tulang belakang.
tampak
seperti ujung bengkak pada tali spinal. Letaknya di antara
bagian
tertentu otak dengan sumsum tulang belakang. Medula
peristaltik,
batuk, dan bersin.
. Batang otak merupakan bagian otak sebelah bawah yang
berhubungan dengan sumsum tulang belakang. Batang otak berfungsi
mengontrol berbagai proses penting bagi kehidupan, seperti bernapas,
denyut jantung, mencerna makanan, dan membuang kotoran.
merupakan
tali putih kemilau berbentuk tabung dari dasar otak menuju ke tulang
belakang. Pada irisan melintangnya, tampak ada dua bagian, yakni bagian
luar yang berpenampakan putih dan bagian dalam yang berpenampakan
abu-abu dengan berbentuk kupu-kupu. Bagian luar sumsum tulang belakang
berwarna putih, karena tersusun oleh akson dan dendrit yang berselubung
mielin. Sedangkan bagian dalamnya berwarna abu-abu, tersusun oleh badan
sel yang tak berselubung mielin dari interneuron dan neuron motorik.
Apabila sumsum tulang belakang diiris secara vertikal, bagian dalam
berwarna abu-abu terdapat saluran tengah yang disebut ventrikel dan
berisi cairan serebrospinal. Ventrikel ini berhubungan juga dengan
ventrikel di dalam otak. Bagian dalamnya mempunyai dua akar saraf yaitu
yang berisi saraf motorik ke arah perut.
Sumsum tulang belakang memiliki fungsi penting dalam tubuh. Fungsi
tersebut antara lain menghubungkan impuls dari saraf sensorik ke otak
dan sebaliknya, menghubungkan impuls dari otak ke saraf motorik;
memungkinkan menjadi jalur terpendek pada gerak refleks. Mekanisme
penghantaran impuls yang terjadi pada tulang belakang yakni sebagai
berikut; rangsangan dari reseptor dibawa oleh neuron sensorik menuju
sumsum tulang belakang melalui akar dorsal untuk diolah dan ditanggapi.
Selanjutnya, impuls dibawa neuron motorik melalui akar ventral ke
efektor untuk direspons.
merupakan bagian dari sistem saraf
tubuh yang meneruskan rangsangan (impuls) menuju dan dari system saraf
pusat. Karena itu, di dalamnya terdapat serabut saraf sensorik (saraf
aferen) dan serabut saraf motorik (saraf eferen).
adalah sekumpulan neuron yang
menghantarkan impuls dari reseptor menuju sistem saraf pusat. Sedangkan
berperan dalam menghantarkan
impuls dari sistem saraf pusat menuju efektor (otot dan kelenjar) untuk
ditanggapi.
Berdasarkan asalnya, sistem saraf tepi terbagi atas saraf kranial dan
saraf spinal yang masing-masing berpasangan, serta ganglia (tunggal:
ganglion).
merupakan semua saraf yang
keluar dari permukaan dorsal otak.
ialah semua saraf yang keluar dari kedua sisi tulang belakang.
Masing-masing saraf ini mempunyai karakteristik fungsi dan jumlah saraf
yang berbeda. Sementara itu,
merupakan kumpul
an badan sel saraf yang membentuk simpul-simpul saraf dan di luar sistem
saraf pusat.
merupakan sekumpulan saraf
yang mengatur aktivitas yang tidak kita pikirkan terlebih dahulu.
Misalnya saja, pergerakan paru-paru dan jantung. Kita tidak pernah
berkehendak supaya aktivitas gerakan paru-paru dan jantung terjadi
dengan koordinasi oleh sistem saraf pusat. Oleh karena itu, sistem saraf
sadar disebut juga
. Organ yang
beraktivitas dan dikontrol oleh sistem saraf sadar, meliputi kelenjar
keringat, otot perut, pembuluh darah, dan alat-alat reproduksi.
Menurut karakteristik kerjanya, sistem saraf sadar terbagi atas dua
saraf, meliputi
. Masing-masing saraf ini dapat bekerja pada organ
yang sama, namun kerja yang dilakukan saling berlawanan (antagonis).
Sebagai contoh, saat saraf simpatik memengaruhi sebuah organ untuk
mening katkan aktivitas organ tertentu, justru saraf parasimpatik malah
menurunkannya. Perbedaan ini terjadi karena neurotransmiter yang
dihasilkan kedua saraf tersebut berbeda. Noradrenalian merupakan
neurotransmiter saraf simpatik, sedangkan asetilkolin ialah
neurotransmiter saraf parasimpatik.
Pada saraf simpatik dan saraf parasimpatik terdapat penghubung antara
sistem saraf pusat dan efektor, yang dinamakan
.
Ganglion saraf simpatik berada dekat sumsum tulang belakang. Serabut
praganglion saraf simpatik berukuran pendek, sementara serabut
pascaganglionnya berukuran panjang. Sebaliknya, saraf parasimpatik
memiliki serabut praganglion yang berukuran panjang dan serabut
pascaganglion yang pendek.
Mengenal sistem pernapasan merupakan salah satu
bentuk upaya kita mengenal lebih dalam salah satu proses penting dalam
tubuh.
Bayangkan, bila terjadi gangguan pada sistem pernapasan,
apa yang akan terjadi pada tubuh kita?
Sistem pernapasan atau
sistem respirasi adalah suatu proses mulai dari pengambilan oksigen,
pengeluaran karbohidrat hingga penggunaan energi di dalam tubuh.
Manusia
dalam bernapas menghirup oksigen dalam udara bebas dan membuang
karbondioksida ke lingkungan. Normalnya manusia butuh kurang lebih 300
liter oksigen (O2) perhari. Dalam keadaan tubuh bekerja berat maka
oksigen yang diperlukan pun menjadi berlipat-lipat kali dan bisa sampai
10 - 15 kali lipat. Ketika oksigen tembus selaput alveolus, hemoglobin
akan mengikat oksigen yang banyaknya akan disesuaikan dengan besar kecil
tekanan udara.
Sistem pernapasan sangat penting bagi tubuh manusia karena proses
respirasi tidak dapat berhenti bahkan untuk beberapa detik. Jika proses
respirasi berhenti bahkan untuk satu atau dua menit, kondisi akan
menjadi serius dan akhirnya akan berakhir dengan kematian.
1. Pengertian Iman kepada Kitab-kitab Allah SWT.
a. Pengertian Iman
Menurut bahasa, iman berasal dari bahasa Arab yaitu
أَمَنَ- يُؤْمِنُ- إِيْمَان
artinya “membenarkan”. Sedangkan menurut istilah, iman ialah kepercayaan
dalam hati, meyakini dan membenarkan adanya Tuhan dan membenarkan semua
yang dibawa oleh Nabi Muhammad SAW.
b. Pengertian Kitab-Kitab Allah swt.
Kitab Allah ialah wahyu Allah SWT yang disampaikan kepada para Rasul
untuk diajarkan kepada umat manusia sebagai petunjuk dan pedoman
hidup.Tujuan Allah menurunkan kitab-kitab itu agar digunakan sebagai
pedoman hidup bagi seluruh manusia menuju jalan hidup yang benar dan
diridhai-Nya
Jadi, iman kepada kitab-kitab Allah SWT adalah mempercayai dan
meyakini dengan sepenuh hati bahwa Allah SWT. telah menurunkan
kitab-kitab-Nya kepada rasul yang berisi wahyu untuk disampaikan dan
diajarkan kepada umat manusia.
2. Suhuf
Selain kitab-kitab, di dalam al-Quran disebutkan adanya Suhuf atau
Sahifah (halaman), yang berjumlah seratus Sahifah. Suhuf adalah firman
Allah swt. yang diturunkan kepada para Nabi atau rasul-Nya yang berisi
hukum-hukum dasar sebagai petunjuk dan pedoman dalam menjalankan
agama-Nya. Sahifah ini diberikan Allah SWT kepada tiga orang Nabi-Nya,
masing-masing dengan rincian sebagai berikut:
- 60 Sahifah kepada nabi Syits a.s.
- 30 Sahifah kepada nabi Ibrahim a.s.
- 10 Sahifah kepada nabi Musa a.s.
Firman Allah swt.:
( إِنَّ هَذَا
لَفِى الصُّحُفِ اْلأُوْلَى (18) صُحُفِ إِبْرَهِيْمَ وَمُسَ .(19)
Artinya:
“Sesungguhnya ini semua benar-benar terdapat di dalam
suhuf yang pertama(yaitu) suhuf-suhuf Nabi Ibrahim a.s. dan Nabi Musa
a.s.”(Qs.al-a’la: 18-19).
3. Dalil-dalil Naqli yang terkait dengan Iman kepada
Kitab-kitab Allah
Beriman kepada kitab-kitab Allah SWT. merupakan rukun iman yang
ketiga. Umat Islam wajib percaya dan meyakini dengan sungguh-sungguh
bahwa semua kitab yang telah diturunkan Allah SWT.kepada para Rasul-Nya
pasti benar. Firman Allah swt.:
( ياَأَيُّهَا الَّذِيْنَ
أَمَنُوْا بِاللهِ وَرَسُوْلِهِ وَاْلكِتَبِ اَّلذِيْ نَزَّلَ عَلَى
رَسُوْلِهِ وَاْلكِتَبِ اَّلذِيْ أَنْزَلَ مِنْ قَبْلُ… .(النساء : 136
Artinya:
“Wahai orang-orang yang beriman, tetaplah kamu sekalian
beriman kepada Allah dan rasul-Nya dan kepada kitab yang Allah turunkan
kepada rasul-Nya dan kitab-kitab yang diturunkan sebelumnya.”(Qs.An-Nisa’:136)
Firman Allah swt.:
Artinya:
“Dan Kami telah turunkan kepadamu al-Quran dengan
membawa kebenaran, membenarkan apa yang sebelumnya, yaitu kitab-kitab
(yang diturunkan sebelumnya) dan batu ujian terhadap kitab-kitab yang
lain itu. Maka putuskanlah perkara mereka menurut apa yang Allah
turunkan dan janganlah kamu mengikuti hawa nafsu mereka dengan
meninggalkan kebenaran yang telah datang kepadamu. Untuk tiap-tiap umat
di antara kamu, Kami berikan aturan dan jalan yang terang, niscaya Allah
menghendaki niscaya kamu dijadikan satu umat saja, tetapi Allah hendak
menguji kamu terhadap pemberian-Nya kepadamu. Maka berlomba-lombalah
bebuat kebajikan. Hanya kepada Allah-lah kembali kamu semuanya….(al-Maidah
:48)
Kitab-kitab yang dimaksud dalam ayat di atas berisi peraturan,
ketentuan, perintah dan larangan yang dijadikan pedoman bagi umat
manusia dalam menjalankan kehidupan agar tercapai kebahagiaan hidup di
dunia dan di akhirat. Kitab-kitab Allah swt. diturunkan pada masa yang
berlainan, namun di dalamnya terkandung ajaran pokok yang sama, yaitu
ajaran tauhid atau ajaran tentang keesaan Allah swt. Yang berbeda
hanyalah dalam hal syariat yang disesuaikan dengan zaman dan keadaan
umat pada waktu itu.
4. Nama-nama kitab Allah swt. dan Rasul yang menerimanya.
Di antara kitab-kitab Allah swt. yang wajib kita imani ada empat (4)
yaitu:
a. Kitab Taurat
Kitab Taurat diwahyukan Allah swt. kepada nabi Musa a.s. sebagai
pedoman hidup bagi kaum Bani Israil.
Firman Allah swt:
(إِنَّا أَنْزَلْنَا
الَّتوْرَاةَ فِيْهَا هُدًى وَّنُوْرٌ…(المائدة:44
Artinya:
“Sesungguhnya Kami telah menurunkan kitab Taurat di
dalamnya (ada )petunjuk dan cahaya(yang menerangi)”….( Q.S
Al-Ma’idah: 44)
Taurat asli yang berisikan akidah dan hukum-hukum syariat sudah tidak
ada lagi. Yang beredar di kalangan orang-orang Yahudi saat ini bukanlah
Taurat asli, melainkan palsu. Sebab, mereka telah melakukan
perubahan-perubahan isinya (ajarannya). Para ulama pun sepakat bahwa
taurat yang murni sudah tidak ada lagi. Taurat yang beredar saat
sekarang lebih tepat dikatakan sebagai karangan atau tulisan orang-orang
Yahudi pada waktu dan masa yang berbeda.
Allah berfirman:
( مِنَ الَّذِيْنَ هَادُوْا
يُحَرِّفُوْنَ اْلكَلِمَ عَنْ مَوَاضِعِهِ…(النساء: 75
Artinya:
“Yaitu orang-orang Yahudi mereka mengubah perkataan dari
tempat-tempatnya.”(Qs. An-Nisa’46).
b. Kitab Injil
Kitab Injil diwahyukan oleh Allah swt. kepada Nabi Isa a.s. Kitab
Injil yang asli memuat keterangan-keterangan yang benar dan nyata yaitu
perintah-perintah Allah SWT agar manusia mengesakannya dan tidak
menyekutukan-Nya dengan suatu apapun, juga menjelaskan bahwa di akhir
zaman akan lahir Nabi yang terakhir.
Kitab Injil yang beredar sekarang hanyalah hasil pikiran manusia
bukan wahyu Allah . Misalnya Kitab Injil matius, Injil lukas dan Injil
Johanes. Antar Injil tersebut banyak terdapat perbedaan dan bahkan
bertentangan. Menurut para ahi, isi dari kitab Injil adalah biografi
Nabi isa a.s. dan keyakinan yang ada di dalam ajarannya merupakan
pikiran paulus, bukan pendapat orang-orang harawi (pengikut-pengikut
nabi isa a.s.) . Ada juga yang dinamakan Injil Bernabas, oleh para ulama
dianggap sesuai dengan ajaran tauhid. Namun Injil jenis ini tidak
dipakai oleh orang-orang Kristen (Nasrani). Dengan demikian, yang wajib
dipercayai oleh umat islam hanyalah Injil yang diturunkan Allah
SWT.kepada nabi isa a.s.
Firman Allah swt.:
(
وَأَتَيْنَهُ اْلإِنْجِيْلَ فِيْهِ هُدَى وَّنُوْرٌ…(المائدة : 46
Artinya:
“Dan Kami telah memberikan kepadanya (Isa) kitab Injil
sedang didalamnya (ada) petunjuk dan cahaya (yang menerangi)”
…(al-Maidah 46)
c. Kitab Zabur
Kitab zabur diwahyukan Allah swt. Kepada nabi Daud a.s. Nabi Daud
hanya diperintahkan oleh Allah SWT untuk mengikuti syariat Nabi Musa.
Maka pokok ajaran kitab Zabur berisi tentang zikir, nasehat dan hikmah
tidak memuat syariat.
Firman Allah swt.:
( وَاَتَيْنَا دَاوُدَ
زَبُوْرًا (الاءسراء : 55
Artinya:
“Dan kami berikan Zabur kepada Daud a.s“(al-Isra’ :
55)
d. Kitab al-Quran
Al-Quran diturunkan Allah swt.kepada Nabi Muhammad saw. Melalui
malaikat Jibril itu tidak sekaligus, melainkan secara berangsur-angsur,
yang waktu turunnya selama 22 tahun 2 bulan 22 hari. Terdiri dari 30
juz, 144 surat, 6666 ayat, 74.437 kalimat, dan 325.345 huruf. Turunnya
al-Quran disebut Nuzulul Quran. Wahyu pertama berupa surat Al-‘Alaq ayat
1-5, diturunkan pada malam 17 Ramadhan tahun 610 m. Di Gua Hira ketika
Nabi Muhammad sedang berkhalwat. Pada saat itu pula Nabi Muhammad saw.
dinobatkan sebagai Rasulullah atau utusan Allah swt. untuk menyampaikan
risalahNya kepada seluruh umat. Sedangkan ayat yang terakhir turun
adalah surat al-Maidah ayat 3, ayat tersebut turun pada tanggal 9
Dzulhijjah tahun 10 hijriyah di padang ‘Arafah ketika beliau sedang
menunaikan haji wada’ (haji perpisahan), karena beberapa hari sesudah
menerima wahyu tersebut nabi Muhammad saw wafat. Al-Quran diwahyukan
kepada Nabi Muhammad saw. Sebahagian isinya menghapus sebahagian
syari’at yang tertera dalam kitab-kitab terdahulu dan melengkapinya
dengan hukum yang sesuai dengan hukum syariat yang sesuai dengan
perkembangan zaman. Al-Quran merupakan kitab suci terlengkap dan abadi
sepanjang masa , berlaku bagi semua umat manusia sampai akhir zaman,
serta pedoman dan petunjuk bagi manusia dalam menjalankan kehidupan di
dunia agar tercapai kebahagiaan di akhirat. Oleh karena itu,sebagai
muslim kita tidak perlu meragukannya sama sekali. Firman Allah:
(وَاَنْزَلْنَا اِلَيْكَ
اْلكِتَبَ بِالْحَقِّ مُصَدِّقَا لِّمَابَيْنَ يَدَيْهِ مِنَ الْكِتَبِ
وَمُهَيْمِنًا عَلَيْهِ…(المائدة :48
Artinya:
“Dan Kami telah turunkan kepadamu al-Quran dengan
membawa kebenaran, membenarkan apa yang sebelumnya, yaitu kitab-kitab
(yang diturunkan sebelumnya) dan batu ujian terhadap kitab-kitab yang
lain itu…(al-Maidah : 48)
Firman Allah swt.:
(ذَلِكَ الْكِتَبُ لاَرَيْبَ
فِيْهِ هُدًى لِلْمُتَّقِيْنَ (البقره:2
Artinya:
“Kitab (al-Quran) ini tidak ada keraguan
padanya,petunjuk bagi orang-orang yang bertakwa”.(Qs.al-Baqarah:2)
Isi pokok kandungan al-Quran adalah:
1. aqidah atau keimanan
2. Ibadah baik ibadah mahdhah maupun ghairu mahdhah
3. Akhlak seorang hamba kepada khaliq, kepada sesama manusia dan alam
sekitarnya
4. Mu’amalah yaitu hubungan manusia dengan sesama manusia
5. Wa’ad dan wa’id
6. Kisah kisah nabi dan rasul, orang-orang shaleh dan orang-orang
yang inkar
7. Ilmu pengetahuan.
Keistimewaan kitab suci al-Quran dibanding dengan kitab-kitab yang
diturunkan sebelumnya adalah sebagai berikut:
a. Al-Quran sebagai kitab suci yang terakhir dan terjamin
keasliannya. Al-Quran sebagai kitab suci yang terakhir selalu dijaga
kemurnian dan keasliannya oleh Allah swt. sampai akhir zaman.
firman Allah swt.:
(إِنَّا نَحْنُ نَزَّلْنَا
الذِّكْرَ وَإِنَّالَهُ لَحَفِضُوْنَ(الحجر:9
Artinya:
“Sesungguhnya kamilah yang menurunkan al-Quran dan
sesungguhnya Kami benar-benar memeliharanya.”(al-hijr:9)
b. Al-Quran memiliki isi kandungan yang paling lengkap dan sempurna.
Isi al-Quran mencakup segala aspek kehidupan manusia.
c. Al-Quran tidak dapat ditiru dan dimasuki oleh ide-ide manusia yang
ingin menyimpangkannya karena Allah swt. yang selalu memeliharanya.
Allah swt. Berfirman:
قُلْ لَئِنِ اجْتَمَعَتِ
اْلإِنْسُ وَالْجِنُّ عَلَى أَنْ يَّأْتُوْا بِمِثْلِ هَذَا اْلقُرْأَنَ
لاَ يَْأتُوْنَ بِمِثْلِهِ وَلَوْ كَانَ بَعْضُهُمْ لِبَعْضٍ ظَهِيْرًا (
الإسراء :88
Artinya:
“Katakanlah, sesungguhnya jika manusia dan jin berkumpul
untuk membuat yang serupa al-Quran ini, niscaya mereka tidak akan dapat
membuat yang serupa dengan dia. Sekalipun sebahagian mereka menjadi
pembantu bagi sebahagian yang lainnya.”( Qs.al-Isra’88)
d. Al-quran isinya sesuai dengan perkembangan zaman, berlaku
sepanjang masa dan untuk seluruh umat manusia.
e. Membaca dan mempelajari isi al-Quran adalah ibadah. Masih banyak
keistimewaan al-Quran dibanding dengan kitab-kitab sebelumnya.
Oleh karena itu, sebagai kitab suci umat Islam, kita harus berusaha
mempelajari dan mengkaji al-Quran dengan sungguh-sungguh, insya Allah
akan diperoleh berbagai keuntungan untuk hidup di dunia dan di akhirat.
Karena dengan hanya membaca saja sudah merupakan ibadah kepada Allah
apalagi jika kita dapat memahami dan mengamalkannya.
Sabda Rasulullah saw.:
(عَلَيْكَ بِتِلاَوَةِ
اْلقُرْأَنَ فَإِنَّهُ نُوْرٌ لَّكَ فِى اْلأَرْضِ وَذُخْرُ لَكَ فِى
السَّمَاءِ (رواه ابن ماجه
Artinya:
“atas engkau membaca al-Quran adalah cahaya bagimu
dibumi dan simpananmu dilangit.”(HR. Ibn Majah)
5. Menjadikan al-Quran sebagai sumber hukum dan pedoman dalam
kehidupan sehari-hari.
Dalam kehidupan sehari-hari banyak problem kehidupan yang tidak dapat
diatasi oleh manusia.sepertinya:
- Berbagai macam jenis penyakit timbul tanpa diketahui cara
pengobatannya,
- terjadinya bencana yang tidak disangka-sangka,
- terjadinya gejolak sosial,dsb.
Semuanya itu merupakan dampak sikap sikap manusia yang meninggalkan
al-Quran. Padahal Rasulullah saw. Telah berpesan dalam sabdanya yang
berbunyi:
تَرَكْتُ فِيْكُمْ أَمْرَيْنِ
مَا إِنْ تَمَسَكْتُمْ بِهِمَا لَنْ تَضِلُّوْا أَبَدًا كِتَااللهِ
وَسُنَةَ رَسُوْلَهُ. (رواه حكيم
Artinya:
“kutinggalkan untukmu dua perkara (pusaka), kalian tidak
akan tersesat selama berpegang kepada keduanya, yaitu (al-Quran) dan
sunnnah rasulNya.”(al-Hakim) Dengan membaca dan mempelajari dan
menggali isi kandungan ilmu pengetahuan yang ada dalam al-Quran,akan:
- Menghilangkan kegelisahan bathin, bahkan penyakit jiwa yang erat
kaitannya dengan penyakit jasmani.
- Meningkatkan kewaspadaan diri untuk selalu menjalankan segala
perintah-Nya dan meninggalkan segala larang-Nya.
- Meningkatkan kesadaran bahwa apa yang diperbuat di atas dunia ini
akan dipertanggung jawabkan di akhirat kelak.
Dengan demikian, selaku seorang muslim haruslah kita:
- Menjadikan al-Quran sebagai petunjuk dan pedoman hidup ini, dan
jangan berpedoman dengan yang lainnya,
- Berusaha untuk selalu menghormati, memuliakan dan menjunjung tinggi
kitab suci al-Quran.
- Senantiasa membaca al-Quran dalam segala kesempatan di kala suka
maupun duka.
- berusaha untuk memahami arti dan isi kandungannya
- berusaha untuk mengamalkan isi kandungannya di dalam kehidupan
sehari-hari.
6. Fungsi beriman kepada kitab-kitab Allah swt.
a. Mempertebal keimanan kepada Allah swt. Karena banyak hal-hal
kehidupan manusia yang tidak dapat dijawab oleh ilmu pengetahuan dan
akal manusia, maka kitab-kitab Allah mampu menjawab
permasalahan-permasalahan yang berkaitan dengan kehidupan manusia, baik
yang nampak maupun yang gaib.
b. Memperkuat keyakinan seseorang kepada tugas Nabi Muhammad saw.
Karena dengan meyakini kitab-kitab Allah swt. Maka akan percaya terhadap
kebenaran al-Quran dan ajaran yang dibawa oleh nabi Muhammad saw.
c. Menambah ilmu pengetahuan. Karena di dalam kitab-kitab Allah, di
samping berisi tentang perintah dan larangan Allah, juga menjelaskan
tentang pokok-pokok ilmu pengetahuan untuk mendorong manusia
mengembangkan dan memperluas wawasan sesuai dengan perkembangan zaman.
d. Menanamkan sikap toleransi terhadap agama lain. Karena dengan
beriman kepada kitab-kitab Allah maka umat Islam akan selalu menghormati
dan menghargai orang lain. Hal ini sesuai dengan apa yang dijelaskan
dalam al-Quran dan hadits.
Kesimpulan :
1. Iman kepada kitab Allah swt. adalah rukun iman yang ketiga.
2. Pengertian Iman kepada kitab Allah swt adalah meyakini dan
membenarkan bahwa Allah swt telah menurunkan Wahyu-Nya kepada para
Rasul, yang termuat di dalam Kitab-kitabNya.(Taurat, Zabur, Injil dan
al-Quran).
3. Isi pokok dari semua kitab Allah swt ini sama yaitu bertauhid dan
mengesakan Allah swt.
4. Kitab al-Quran memiliki keistimewaan dibanding kitab yang lainnya,
di antara keistimewaan itu adalah, bahwa: – Al-Quran berlaku untuk
seluruh umat manusia – Al-Quran terjamin pemeliharaannya sampai akhir
zaman.
5. Fungsi utama beriman kepada kitab Allah swt adalah sebagai pedoman
bagi umat manusia untuk memperoleh kebahagiaan hidup di dunia dan
akhirat
6. FISIKA
A. DINAMIKA ROTASI
Sekarang tibalah saatnya kita
mempelajari mengapa benda itu dapat berputar. tentunya dalam gerak
melingkar kalian hanya mempelajari besarannya saja, seperti bagaimana
kecepatan putarannya, percepatannya, perubahan posisi sudutnya.
Nah…konsep-konsep tersebut nanti kita akan perlukan di bahasan ini.
waduh lupa nih!! ga pa2, buka lagi bukumu..bukan nyontek ini kok!
Okeh..kita mulai. Dinamika rotasi merupakan kajian fisika yang
mempelajari tentang gerak rotasi sekaligus mempelajari penyebabnya.

Amati Phenomena berikut: Pada gerak lurus,
gaya
merupakan penyebab benda bergerak lurus sedangkan dalam gerak rotasi
momen
gaya /Torque/Torsi (t”tau”–
Nm) merupakan penyebab benda bergerak rotasi. Ini berarti
makin besar momen gaya makin mudah suatu benda dapat berotasi.
Dari gambar tersebut, Menurut Anda, di
titik manakah gaya harus bekerja agar Mur poros roda sepeda motor mudah
berputar/berotasi? Jika kita amati, besarnya momen gaya tergantung dari
besar gaya yang diberikan dan lengan momennya (jarak dari sumbu rotasi
yang tegak lurus dengan vektor gaya). Secara matematis ditulis:
τ = F.r 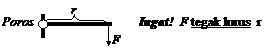
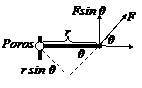
Triks: Jika F tidak tegak lurus r maka harus dicari dulu
komponen F atau r agar saling tegak lurus (lihat gambar!). Maka,
syaratnya anda harus bisa menguraikan
suatu vektor pada sumbu x dan y! pokoknya silahkan uraikan vektor
F atau r yang akan anda uraikan. yang penting keduanya kita peroleh
cektor yang saling tegak lurus. Maka dari rumus dasar momen gaya kita
ubah menjadi:
τ = F sin Θ . r atau
τ = F. r sin Θ
Adapun arah momen gaya dapat kita tentukan dengan aturan tangan kanan
dimana lipatan keempat jari menunjukkan arah putaran gaya sedangkan ibu
jari menunjukkan arah momen gaya. Sebagai perjanjian tanda, jika benda
berputar
searah jarum jam, momen gaya diberi tanda
negatif
sedangkan jika
berlawanan arah jarum jam diberi tanda
Positif.
Aplikasinya: dari rumus tersebut besarnya momen gaya atau dengan kata
lain benda mudah berputar, dipengaruhi besarnya gaya dan jarak poros ke
suatu titik gaya itu bekerja. Nah.. contohnya gini, tentunya kita akan
menutup/membuka pintu dengan mendorongya tidak dekat porosnya, karena
ini lebih berat dibanding membuka dekat daun pintunya. Betulkan….
Silahkan terapkan dalam aplikasi lainnya, tentunya banyak sekali kita
terapkan dalam kehidupan sehari-hari
Keseimbangan
Oleh: Albert Hendra Wijaya
Makan adalah salah satu kebutuhan pokok, setiap orang membutuhkan
makanan (termasuk minuman) untuk kelangsungan hidupnya. Makanan sangat
beragam jenisnya, yang berbeda-beda dari bentuk, aroma dan rasanya.
Manusiapun berbeda-beda selera dan kesukaannya. Makanan selain untuk
kelangsungan hidup, dengan cita rasa kenikmatannya juga menjadi pemuas
selera disamping sebagai pemenuhan kesehatan.
Makanan yang baik adalah makanan yang bercita rasa tinggi sesuai selera
dan dapat memenuhi kebutuhan kesehatan dengan menjamin tersedianya
zat-zat yang diperlukan tubuh serta ekonomis. Tentunya untuk mendapatkan
suatu masakan yang baik itu harus ada resepnya dimana yang terpenting
dari semua itu adalah adanya suatu keseimbangan yang terkontrol dengan
baik sehingga bisa mendapatkan hasil yang terbaik.
Dalam dunia kedokteran ada semacam pepatah yang mengatakan "Obat adalah
racun", yang mana maksudnya adalah jika seseorang sakit (dalam
pengertian adanya ketidak seimbangan zat dalam tubuhnya) maka orang
tersebut dapat diobati dengan pemberian zat tertentu dalam jumlah
tertentu (dosis) dengan maksud mengupayakan terciptanya kembali
keseimbangan tersebut.
Ketidak seimbangan pada orang yang sakit (secara normal) itu bisa karena
kekurangan atau kelebihan zat tertentu yang mengakibatkan kelainan atau
terganggunya metabolisme tubuh. Pemberian zat (obat) haruslah tepat dan
terukur, karena diluar batas-batas tertentu justru dapat dikatakan
pemberian zat (racun) itu akan berbahaya karena justru memperparah
ketidakseimbangan yang ada.
Seperti kita ketahui bahwa air sangat penting bagi kehidupan manusia,
tetapi bagi sebagian yang tinggal di kota-kota besar, air (yang sehat)
sekarang sudah semakin sulit didapatkan sehingga kini bahkan harus
dibeli. Ya, memang air sekarang sudah mahal karena kini kita harus
membayar pada manusia yang memproduksinya, menggantikan pekerjaan alam.
Semua itu adalah harga yang harus kita bayarkan untuk
pekerjaan-pekerjaan manusia dalam rangka meninggikan harkat
kehidupannya, walaupun berbuntut panjang mengganggu siklus alam dan
akhirnya mengganggu keseimbangan alam. Manusia itu memang kadang berbuat
tanpa sadar akan akibat dari semua perbuatannya yang pada akhirnya
lebih banyak menimbulkan kesusahan pada manusia sendiri.
Dari contoh-contoh kecil diatas dapat kita ketahui begitu penting adanya
keseimbangan itu, baik secara mikro maupun makro. Jika misalnya kita
ditanyakan "Bagaimana hidup yang seimbang itu?" Maka masing-masing dari
kita semua mungkin bisa memberikan jawabannya, tetapi tentu saja
jawaban dari semuanya akan berbeda karena biasanya kita memberikan
pendapat sesuai dengan pandangan kita.
Mendengar kata "seimbang", maka pada umumnya terlintas dalam benak kita
ada dua hal atau keadaan yang dalam posisi sama kuat. Keseimbangan dalam
suatu pembahasan sempit yang specific, terasa seperti membicarakan
"keadilan", ini disebabkan karena memang keadilan itu adalah bagian dari
keseimbangan itu secara utuh.
Didalam ajaran Tao (

) pun
"keseimbangan" menduduki salah satu posisi tertinggi diantara
kaidah-kaidah yang ada. Yang dimaksud "keseimbangan" disini dalam banyak
kasus justru tidak sekedar memperlihatkan adanya perimbangan dari dua
hal saja. Keseimbangan dalam Tao memiliki arti yang demikian dalam dan
luas, berkaitan erat dengan konsep "kealamiahan".
Keseimbangan yang dimaksud dalam Tao (

) itu hampir dapat
dikatakan bukanlah atau tidak mendekati sama sekali persamaan-persamaan
perhitungan matematis yang menunjukkan bilangan-bilangan dan formulasi
yang baku dan tetap, tetapi lebih mendekati suatu proses management yang
mengatur penempatan masing-masing di posisi dan waktu yang tepat serta
fungsinya untuk kelangsungan keseluruhannya. Keseimbangan dalam
pandangan imaginasi dapat dibayangkan bagaikan suatu kekuatan-kekuatan
dari segala unsur yang dalam interaksinya yang begitu komplekspun tetap
mengikuti suatu hukum keteraturan yang harmonis. Keberadaan keseimbangan
itu sendiri secara makro maupun mikro selalu berkembang dan berubah
dengan caranya yang sangat unik.
Keseimbangan pada tingkat tertinggi berada dan meliputi alam semesta ini
secara keseluruhan, dan secara mutlak juga menguasai sampai pada
segmen-segmen yang lebih kecil bahkan yang terkecilpun. Dalam kehidupan
dunia sehari-haripun kita tidak pernah luput dari kekuatan keseimbangan.
Sampai pada tingkat tertentu yang masih berskala sangat mikro, manusia
memang dianggap mempunyai sedikit peranan dalam memperngaruhi keadaan
kondisi alam lingkungannya. Akan tetapi semua upaya manusia itu tidak
dapat bertahan atau luput sama sekali terhadap koreksi yang dilakukan
oleh keseimbangan alam semesta ini, kecuali jika manusia bisa mengikuti
iramanya.
Karena keseimbangan pada tingkat alam semesta itu menerapkan suatu hukum
"keseimbangan" yang universal. Oleh sebab itu maka semua ketidak
seimbangan yang bersifat mikro atau bahkan yang makro sekalipun akan
terkoreksi dengan sendirinya oleh hukum keseimbangan yang universal
tersebut tanpa memperdulikan proses penyeimbangannya, yang secara
pandangan manusia justru dirasakan sebagai suatu kekacauan
(ketidakseimbangan) tanpa menyadari bahwa pemicu segalanya itu adalah
manusia sendiri.
Kekuatan keseimbangan, dalam proses penyeimbangannya jika ada suatu
gejala yang mengarah ke keadaan tidak seimbang tidak pernah pandang bulu
(karena inilah keadilan yang hakiki) mengkoreksi sebesar apapun dalam
upaya mengembalikan keseimbangan itu, tetapi tentunya ini semua berjalan
secara alamiah, jika terkadang kekuatan keseimbangan itu seakan tidak
bereaksi dalam keberadaannya itu adalah karena ia menggunakan kekuatan
waktu dalam proses eliminasi ketidak seimbangan yang ada.
Baiklah, untuk yang selanjutnya adalah yang lebih realistis kita
berbicara mengenai konsep keseimbangan itu dalam konteks yang lebih
praktis dan lebih mengarah ke penerapannya bagi kita sebagai Tao Yu (


). Karena
penerapannya yang juga demikian luas maka konsep keseimbangan praktis
akan dibahas secara umum saja dan lebih banyak mengarah pada fungsi dan
peranan sosial kita, dimulai dari skala terkecil yaitu diri kita
sendiri.
B.Keseimbangan
Sosok kita sebagai individu bagaimanapun juga adanya, tentu saja harus
kita anggap sebagai suatu yang sangat berharga, dan harus bisa terus
kita kembangkan menuju kesempurnaan yakni dengan jalan Siu Tao (


). Nah dalam
proses Siu Tao (


) yang mencakup
jiwa dan raga, keseimbangan sangat diperlukan agar semua unsur yang ada
dalam proses tersebut tidak berdiri sendiri-sendiri, sebaliknya justru
harus bisa menjadi suatu kesatuan yang saling mengisi menjadikan kita
sebagai manusia yang seutuhnya.
Berbicara segala hal termasuk keseimbangan, maka semuanya haruslah
dimulai dari diri kita sendiri sebelum dapat menginjak dan meningkat
pada lingkungan yang lebih luas. Karena proses keseimbangan yang lebih
luas otomatis terbentuk secara alamiah jika bermodalkan keseimbangan
dari dalam masing-masing individu yang ada.
| C.Energi Kinetik
Rotasi |
 |
Energi kinetik rotasi sebuah benda pejal dapat diturunkan dari
energi kinetik translasi sebagai berikut:
dengan
m =
massa benda dalam kg;
v = kecepatan linier benda dalam m/s2
Ek =
energi kinetik benda dalam joule.
Mengingat v =
ω R maka
Karena mR2 adalah momen inersia maka
rumus energi kinetik rotasi dapat dirumuskan sebagai:
dengan:
Ek
rot = energi kinetik rotasi dalam joule
I = momen
inersia benda dalam kg.m2
ω = kecepatan sudut
dalam rad/s
Usaha
dalam Gerak Rotasi
Perhatikan
gambar berikut ini !
Sebuah gaya F
bekerja pada jarak R dari sumbu putar benda.
Usaha yang
dilakukan oleh sebuah momen gaya  yang bekerja untuk merotasikan sebuah benda
tegar sejauh dθ dapat diperoleh dari rumus gerak linier sebagai berikut: yang bekerja untuk merotasikan sebuah benda
tegar sejauh dθ dapat diperoleh dari rumus gerak linier sebagai berikut:
W
= F.s = F. Rθ; karena F.R adalah momen gaya maka:
dengan
W =
usaha gerak rotasi dalam joule
 = momen gaya dalam kg.m = momen gaya dalam kg.m
θ = sudut yang
dibentuk dalam rad
Dalam gerak
rotasi sebuah momen gaya melakukan kerja pada benda dan mengubah energi
kinetik rotasinya sesuai dengan hubungan
Pada gerak
rotasi juga berlaku hukum kekekalan energi mekanik jika resultan gaya
luar sama dengan nol yaitu :
Ep + Ek tran + Ek rot = tetap
Ep1 + Ek tran 1 + Ek rot 1 = Ep2 +
Ek tran 2 + Ek rot 2
atau
dengan
∆Ep =
perubahan energi potensial
∆Ek tran =
perubahan energi kinetik translasi
∆Ek
rot = perubahan energi kinetik rotasi
7.BAHASA INDONESIA
Dalam menulis Sebuah Naskah Drama
dibutukan Sebuah Metode yang disebut Metode Penulisan
Naskah Drama. Adapun Metode Penulisan Naskah Drama adalah
sebagai berikut:
Sebuah Naskah yang baik haruslah
mempunyai Tema, Lakon dan Plot, Apa yang dinamakan Tema,
Lakon dan Plot, Oke kita langsung saja Sharing.
Tema adalah rumusan inti sari cerita yang dipergunakan
dalam menentukan arah dan tujuan cerita. Dari tema inilah kemudian
ditentukan lakon-lakonnya.
Dalam cerita drama lakon merupakan unsur yang paling
aktif yang menjadi penggerak cerita.oleh karena itu seorang lakon
haruslah memiliki karakter, agar dapat berfungsi sebagai penggerak
cerita yang baik. Disamping itu dalam naskah akan ditentukan
dimensi-dimensi sang lakon
Plot adalah alur atau kerangka cerita. Plot adalah
suatu keseluruhan peristiwa didalam naskah.
B. TEKNIK PENILAIAN PEMBACAAN CERPEN
Oleh: Imron Rosidi
Adik-adik,
pernahkah kalian memberi penilaian pembacaan cerpen teman kalian?
Tahukah kalian cara memberi penilaian? Nah, saat ini kalian dapat
berlatih menanggapi pembacaan cerpen. Bagaimana cara memberikan
tanggapan? Perhatikan uraian berikut!
Kegiatan
pembacaan cerpen tampaknya memang tidak sesering pembacaan puisi. Ini
bukan berarti pembacaan cerpen tidak pernah dilakukan. Bahkan, dalam
acara-acara tertentu, lomba pembacaan cerpen sering juga diadakan. Jika
Anda disuruh memberi tanggapan atau menilai pembacaan cerpen, apa yang
Anda gunakan sebagai tolok ukur?
Tolok ukur untuk
menilai pembacaan cerpen adalah sama dengan yang digunakan untuk
menilai pembacaan puisi. Biasanya ada tiga hal yang digunakan sebagai
tolok ukur penilaian, yaitu aspek (a) penghayatan, (b)
pengucapan/pelafalan, dan (c) penampilan. Aspek penghayan menyangkut
(i) pemahaman dan penghayatan pembaca terhadap isi cerpen yang dibaca,
dan (b) kepekaan perasaan pembaca terhadap isi cerpen yang dibaca .
Aspek pengucapan menyangkut (i) ketepatan pelafalan bunyi-bunyi bahasa,
(ii) kejelasan pengucapan bunyi-bunyi bahasa, (iii) ketepatan penggunaan
tempo (cepat-lambat) pembacaan, (iv) ketepatan penggunaan intonasi,
(v) ketepatan penggunaan nada (tinggi-rendah), dan (vi) ketepatan dalam
penggunaan modulasi (perubahan desah), dan aspek penampilan menyangkut
(a) keberanian dan ketenangan penampilan, (b) kesesuaian penggunaan
mimik, dan (c) kewajaran gerak yang dilakukan. |
|
C.CERPEN,
NOVEL DAN HIKAYAT
CERPEN, NOVEL DAN HIKAYAT
A. Definisi Cerpen
Dalam Kamus Besar Bahasa Indonesia (Depdikbud, 1997:186-187), Cerita
Pendek adalah karya sastra yang berupa kisahan pendek (kurang dari
10.000 kata) yang memberikan kesan tunggal yang dominan dan memusatkan
diri pada satu tokoh dalam satu situasi (pada suatu ketika).
Berdasarkan pengertian di atas, cerita pendek mengisahkan kehidupan sang
tokoh yang berada dalam satu peristiwa atau satu kejadian. Tokoh yang
dikisahkan dapat berupa tokoh imajinatif atau tokoh nyata yang dekat
dengan kehidupan pengarangnya.
B. Definisi Novel
Secara hakiki, novel merupakan karangan prosa yang panjang, mengandung
rangkaian cerita kehidupan seseorang dengan orang-orang di sekitarnya
serta menonjolkan watak dan sifat setiap pelaku. Biasanya, cerita dalam
novel dimulai dari peristiwa atau kejadian terpenting yang dialami oleh
tokoh cerita, yang kelak mengubah nasib kehidupannya.
Berbeda dengan cerita pendek, yang umumnya berkisah tentang perilaku
sesaat sang tokoh ketika ia menghadapi suatu peristiwa atau kejadian
pada suatu ketika. Untuk lebih memahami perbedaan antara cerita pendek
dan novel, berikut ini disajikan karakeristik kedua karya sastra (prosa
narasi) tersebut
C. Unsur-unsur Cerpen atau Novel
1. Unsur Intrinsik Cerpen atau Novel
a. Penokohan
Tokoh merupakan individu rekaan yang mengalami peristiwa atau berlakuan
dalam berbagai peristiwa dalam cerita. Tokoh pada umumnya berwujud
manusia, tetapi dapat juga berwujud binatang atau benda yang diinsankan
(Panuti Sudjiman, 1988:16).
Tokoh merupakan bagian atau unsur dari suatu kebutuhan artistik yaitu
karya sastra yang harus selalu menunjang kebutuhan artistik itu, Kennye
dalam Panuti Sudjiman (1966:25).
Penokohan dalam cerita rekaan dapat diklasifikasikan melalui jenis
tokoh, kualitas tokoh, bentuk watak dan cara penampilannya. Menurut
jenisnya ada tokoh utama dan tokoh bawahan. Yang dimaksud dengan tokoh
utama ialah tokoh yang aktif pada setiap peristiwa, sedangkan tokoh
utama dalam peristiwa tertentu (Stanton, 1965:17).
Ditinjau dari kualitas tokoh, ada tokoh yang berbentuk datar dan tokoh
yang berbentuk bulat. Adapun tokoh yang berbentuk datar ialah tokoh yang
tidak memiliki variasi perkembangan jiwa, karena sudah mempunyai
dimensi yang tetap, sedangkan tokoh yang berbentuk bulat ialah tokoh
yang memiliki variasi perkembangan jiwa yang dinamis sesuai dengan
lingkungan peristiwa yang terjadi. Biasanya tokoh yang berbentuk datar
itu pada dasarnya sama dengan tokoh tipologis, dan tokoh yang berbentuk
built disebut tokoh psikologis. Dengan demikian tokoh tipologis juga
berarti tokoh yang tidak banyak mempersoalkan perkembangan jiwa atau
tidak mengalami konflik psikis, karena sudah mempunyai personalitas yang
mapan. Sedangkan tokoh psikologis adalah tokoh yang tidak memiliki
persoanlitas yang mapan dan selalu dinamis (Kuntowijaya dalam Pradopo
dkk, 11984:91).
Jika dilihat dari cara menampilkan tokohnya ada yang ditampilkan dengan
cara analitik dan dramatik. Penampilan secara anlitik adalah pengarang
langsung memaparkan karakter tokoh, misalnya disebutkan keras hati,
keras kepala, penyayang dan sebagainya. Sedangkan penampilan yang
dramatik, karakter tokohnya tidak digambarkan secara langsung, melainkan
disampaikan melalui; (1) pilihan nama tokoh, (2) penggambaran fisik
atau postur tubuh, dan (3) melalui dialog (Atar Semi, 1984:31-32).
Sering dapat diketahui bahwa cara pengarang menggambarkan atau
memunculkan tokohnya dengan berbagi cara. Mungkin cara pengarang
menampilkan tokoh sebagai pelaku yang hanya di alam mimpi, pelaku
memiliki semangat perjuangan dalam mempertahankan hidupnya, pelaku
memiliki cara yang sesuai dengan kehidupan manusia yang sebenarnya,
maupun pelaku egois, kacau dan mementingkan diri sendiri (Bouton dalam
Aminuddin, 1984).
Penyajian watak tokoh yang dihadirkan pengarang tentunya melahirkan
karakter yang berbeda-beda pula, antara tokoh yang satu dengan tokoh
yang lain. Cara mengungkapkan sebuah karakter dapat dilakukan melalui
pernyataan langsung, melalui peristiwa, melalui percakapan, melalui
menolong batin, melalui tanggapan atas pernyataan atau perbuatan dari
tokoh-tokoh lain dan melalui kiasan atau sindiran. Suatu karakter
mestinya harus ditampilkan dalam suatu pertalian yang kuat, sehingga
dapat membentuk kesatuan kesan dan pengertian tentang personalitas
individualnya. Artinya, tindak-tindak tokoh tersebut didasarkan suatu
motivasi atau alasan-alasan yang dapat diterima atau setidak-tidaknya
dapat dipahami mengapa dia berbuat dan bertindak demikian (Atar Semi,
1988:37-38). Penokohan atau perwatakan adalah pelukisan tokoh cerita,
baik keadaan lahir maupun batinnya termasuk keyakinannya, pandangan
hidupnya, adat-istiadat, dan sebagainya. Yang diangkat pengarang dalam
karyanya adalah manusia dan kehidupannya. Oleh karena itu, penokohan
merupakan unsur cerita yang sangat penting. Melalui penokohan, cerita
menjadi lebih nyata dalam angan pembaca.
Ada tiga cara yang digunakan pengarang untuk melukiskan watak tokoh
cerita, yaitu dengan cara langsung, tidak langsung, dan kontekstual.
Pada pelukisan secara langsung, pengarang langsung melukiskan keadaan
dan sifat si tokoh, misalnya cerewet, nakal, jelek, baik, atau berkulit
hitam. Sebaliknya, pada pelukisan watak secara tidak langsung, pengarang
secara tersamar memberitahukan keadaan tokoh cerita.
Watak tokoh dapat disimpulkan dari pikiran, cakapan, dan tingkah laku
tokoh, bahkan dari penampilannya. Watak tokoh juga dapat disimpulkan
melalui tokoh lain yang menceritakan secara tidak langsung. Pada
Pelukisan kontekstual, watak tokoh dapat disimpulkan dari bahasa yang
digunakan pengarang untuk mengacu kepada tokoh.
b. Alur
Pengertian alur dalam cerita pendek atau dalam karya fiksi pada umumnya
adalah rangkaian cerita yang dibentuk oleh tahapan-tahapan peristiwa,
sehingga menjalin suatu cerita yang dihadirkan oleh para pelaku dalam
suatu cerita (Aminuddin, 1987:83).
Alur atau plot adalah rentetan peristiwa yang membentuk struktur cerita,
dimana peristiwa tersebut sambung sinambung berdasarkan hukum
sebab-akibat (Forster, 1971:93).
Alur adalah struktur rangkaian kejadian dalam cerita yang disusun
sebagai sebuah interelasi fungsional yang sekaligus menandai urutan
bagian-bagian dalam keseluruhan fiksi (Atar Semi, 1988:43-46). Alur
merupakan kerangka dasar yang amat penting. Alur mengatur bagaimana
tindakan-tindakan harus bertalian satu sama lain, bagaimana satu
peristiwa mempunyai hubungan dengan peristiwa lain, bagaimana tokoh
digambarkan dan berperan dalam peristiwa itu yang semuanya terikat dalam
suatu kesatuan waktu.
Urutan peristiwa dalam karya sastra belum tentu merupakan peristiwa yang
telah dihayati sepenuhnya oleh pengarang, akan tetapi mungkin hanya
berasal dari daya imajinasi. Begitu pula urutan peristiwa itu jumlahnya
belum tentu sama dengan pengalaman yang dijumpai dalam kehidupan
sehari-hari. Oleh karena itu, urutan peristiwa yang demikian tidak lain
hanyalah dimaksudkan untuk mendekatkan pada masalah yang dikerjakan
terhadap tujuan dalam karya sastra.
Sehubungan dengan penjelasan tersebut di atas menurut tasrif ada lima
hal yang perlu diperhatikan pengarang dalam membangun cerita, yaitu :
(1) situation, yakni pengarang mulai melukiskan suatu keadaan, (2)
generating circumstances, yaitu peristiwa yang bersangkutan-paut, (3)
ricing action, keadaan mulai memuncak, (4) climax, yaiut peristiwa
mencapai puncak, dan (5) document, yaitu pengarang telah memberikan
pemecahan persoalan dari semua peristiwa.
Dari kelima bagian tersebut jika diterapkan oleh pengarang secara
berurutan no 1-5, maka disebut sebagai alur lurus (progresif), sedangkan
apabila penerapan itu dimulai dari tengah atau belakang disebut sebagai
alur balik (regresif).
Di samping kedua bentuk alur tersebut, ada pula alur yang disebut alur
gabungan. Dalam alur ini dipergunakan sebagian alur lurus dan sebagian
lagi alur sorot balik. Meskipun demikian gabungan dua alur itu juga
dijalin dalam kesatuan yang padu, sehingga tidak menimbulkan kesan
adanya dua buah cerita atau peristiwa yang terpisah, baik waktu atau pun
tempat kejadiannya (Suharianto, 1982:29).
Ditinjau dari padu tidaknya alur dalam sebuah cerita, maka alur dapat
dibedakan menjadi dua jenis, yakni alur rapat dan alur renggang. Dalam
alur rapat hanya tersaji adanya pengembangan cerita pada satu tokoh
saja, sehingga tidak timbul pencabangan cerita, akan tetapi apabila ada
pengembangan tokoh lain selain tokoh utama, maka terjadilah alur
renggang atau terjadi pencabangan cerita.
Dari beberapa batasan di atas jelas masing-masing alur mempunyai
keistimewaan sendiri. Alur lurus dapat memberikan kemudahan bagi pembaca
untuk menikmati cerita dari awal sampai akhir cerita. Akan tetapi lain
halnya dengan alur sorot balik (flash back). Alur ini dapat mengejutkan
pembaca, sehingga pembaca dibayangi pertanyaan apa yang terjadi
selanjutnya dan bermaksud apa pengarang menyajikan kejutan seperti itu.
Dengan demikian pembaca merasa terbius untuk membacanya sampai tuntas.
Dikatakan alur yang berhasil, jika alur yang mampu menggiring pembaca
menyelusuri cerita secara keseluruhan, tidak ada bagian yang tidak
ditinggalkan yang dianggap tidak penting.
c. Latar
Menurut pendapat Aminuddin (1987:67), yang dimaksud dengan setting/latar
adalah latar peristiwa dalam karya fiksi baik berupa tempat, waktu
maupun peristiwa, serta memiliki fungsi fisikal dan fungsi psikologis.
Lebih lanjut Leo Hamalian dan Frederick R. Karel menjelaskan bahwa
setting dalam karya fiksi bukan hanya berupa tempat, waktu, peristiwa,
suasana serta benda-benda dalam lingkungan tertentu, melainkan juga
dapat berupa suasana yang berhubungan dengan sikap, jalan pikiran,
prasangka maupun gaya hidup suatu masyarakat dalam menanggapi suatu
problema tertentu. Setting dalam bentuk terakhir ini dapat dimasukkan ke
dalam setting yang bersifat psikologis (Aminuddin, 1987:68).
Secara rinci Tarigan (1986:136) menjelaskan beberapa maksud dan tujuan
pelukisan latar sebagai berikut :
2) Latar yang dapat dengan mudah dikenal kembali dan dilukiskan dengan
terang dan jelas serta mudah diingat, biasanya cenderung untuk
memperbesar keyakinan terhadap tokoh dan gerak serta tindakannya.
3) Latar suatu cerita dapat mempunyai relasi yang lebih langsung dengan
arti keseluruhan dan arti umum dari suatu cerita.
4) Latar mempunyai maksud-maksud tertentu yang mengarah pada penciptaan
atmosfir yang bermanfaat dan berguna.
Selain menjelaskan fungsi latar sebagai penggambaran tempat (ruang) dan
waktu, latar juga sangat erat hubungannya dengan tokoh-tokoh cerita,
karena tentangnya dapat mengekspresikan watak pelaku (Wellek, 1962:221).
Penggambaran latar yang tepat akan mampu memberikan suasana tertentu
dan membuat cerita lebih hidup. Dengan adanya penggambaran latar
tersebut segala peristiwa, keadaan dan suasana yang dilakukan oleh para
tokoh dapat dirasakan oleh pembaca.
d. Sudut Pandang
Cara pengarang menampilkan para pelaku dalam cerita yang dipaparkannya
disebut sudut pandang, atau biasa diistilahkan dengan point of view
(Aminuddin, 1987:90). Pendapat tersebut dipertegas oleh Atar Semi
(1988:51) yang menyebutkan istilah sudut pandang, atau point of view
dengan istilah pusat pengisahan, yakni posisi dan penobatan diri
pengarang dalam ceritanya, atau darimana pengarang melihat
peristiwa-peristiwa yang terdapat dalam cerita itu.
Sudut pandang membedakan kepada pembaca, siapa menceritakan cerita, dan
menentukan struktur gramatikal naratif. Siapa yang menceritakan cerita
adalah sangat penting, dalam menentukan apa dalam cerita, pencerita yang
berbeda akan melihat benda-benda secara berbeda pula (Montaqua dan
Henshaw, 1966:9).
Lebih lanjut Atar Semi (1988:57-58) menegaskan bahwa titik kisah
merupakan posisi dan penempatan pengarang dalam ceritanya. Ia membedakan
titik kisah menjadi empat jenis yang meliputi : (1) pengarang sebagai
tokoh, (2) pengarang sebagai tokoh sampingan, (3) pengarang sebagai
orang ketiga, (4) pengarang sebagai pemain dan narrator.
e. Gaya
Gaya adalah cara pengarang menampilkannya dengan menggunakan media
bahasa yang indah, harmonis serta mampu menuansakan makna dan suasana
yang dapat menyentuh daya intelektual dan emosi pembaca (Aminuddin,
1987:72). Hal demikian tercermin dalam cara pengarang menyusun dan
memilih kata-kata, tema dan dalam memandang tema atau persoalan,
tercermin dalam pribadi pengarangnya. Oleh Karena itu unsur cerita
sebagaimana tersebut di muka baru dapat sempurna apabila disampaikan
dengan gaya tertentu pula, karena gaya dalam karya sastra adalah bahasa
yang dipergunakan oleh pengarang (Suhariyanto, 1982:37).
Sehubungan dengan pembahasan ini pemberian gaya akan ditinjau melalui
dua sudut, yaitu gaya bahasa dan gaya bercerita, karena pengertian gaya
umumnya dapat dirumuskan sebagai cara pengarang menggambarkan cerita
agar cerita lebih menarik dan berkesan. Hal tersebut erat kaitannya
dengan kemampuan pengarang dalam penulisan cerita dengan penggunaan
bahasa, karena cerita pada dasarnya bermediakan bahasa.
- Gaya Bahasa
Dalam persoalan gaya bahasa meliputi semua herarhi kebahasaan yaitu
pilihan kata secara individual, frase, klausa, kalimat dan mencakup pula
sebuah wacana secara keseluruhan (Keraf, 1984:112).
Pengembangan bahasa melalui sastra dikatakan bersifat pribadi karena
sastra itu sendiri merupakan kegiatan yang pribadi dan perorangan, ia
merupakan pengungkapan apa-apa yang menjadi pilihan pribadinya, hasil
seorang sastrawan melihat lingkungannya dan memandang ke dalam dirinya.
Atar Semi (1988:49) menyatakan bahwa gaya bahasa yang digunakan oleh
sastrawan, meskipun tidaklah terlalu luar biasa, adalah unik, karena
selain dekat dengan watak jiwa penyair; juga membuat bahasa yang
digunakannya berbeda dengan makna dan kemesraannya. Dengan gaya tertentu
seorang pengarang dapat mengekalkan pengalaman rohaninya dan
penglihatan batinnya, serta dengan itu pula ia menyentuh dan menggelitik
hati pembacanya. Karena gaya bahasa itu berasal dari batin seorang
pengarang, maka gaya bahasa yang digunakan oleh seorang pengarang dalam
karyanya secara tidak langsung menggambarkan sikap dan karakteristik
pengarang tersebut.
Sedangkan Muchin Ahmadi, dkk (1984:7) mendifinisikan gaya bahasa sebagai
kenyataan penggunaan bahasa (phenomena) yang istimewa dan tidak dapat
dipisahkan dari cara-cara atau teknik seorang pengarang dalam
merefleksikan pengalaman, bidikan, nilai-nilai kualitas, kesadaran
pikiran dan pandangannya yang istimewa. Secara tentatif tetapi praktis
gaya bahasa dapat dibatasi pengertian dasarnya sebagai suatu pengaturan
kata-kata dan kalimat-kalimat yang paling mengekspresikan tema, ide,
gagasan dan perasaan serta pengalaman pengarang. Secara garis besar gaya
bahasa dapat dibedakan menjadi dua golongan yaitu : (1) gaya bahasa
perasosiasian pikiran, dan (2) gaya bahasa penegasan, penekanan dan
penguatan.
Gaya Berbicara
Pada dasarnya gaya bercerita juga berperan penting bagi pengarang untuk
menulis cerita, di samping gaya bahasa yang dipergunakannya, karena
pengertian gaya cerita atau gaya bahasa pada umumnya dapat dijelaskan
sebagai salah satu metode pengarang dalam melukiskan cerita, sehingga
cerita dapat menarik bagi pembaca.
Dalam penulisan cerita, biasanya setiap pengarang mempunyai gaya yang
lain daripada yang lain. Pengarang biasa memperhatikan latar tepat atau
waktu sebagai pembuka atau penutup cerita, akan tetapi ada pula yang
menekankan pada tokoh atau penokohannya. Oleh karena cerita bermediakan
bahasa, maka gaya bercerita erat kaitannya dengan bentuk cerita yang
ditumpukan dalam bentuk frase, kata, kalimat bahkan paragraf, sehingga
semuanya membentuk struktur wacana cerita (Ihsan, 1990:63).
f. Tema
Menurut Scharbach dalam Aminuddin (1987:91), tema adalah ide yang
mendasari suatu cerita sehingga berperanan juga sebagai pangkal tolak
pengarang dalam memaparkan karya fiksi yang diciptakannya. Lebih lanjtu
Brooks berpendapat seperti yang dikutip Aminudddin (1987:72), bahwa
dalam mengapresiasi suatu cerita, apresiator harus memahami ilmu
humanitas, karena tema sebenarnya merupakan pendalaman dan hasil
kontemplasi pengarang yang berkaitan dengan masalah kemanusian serta
masalah lain yang bersifat universal.
Tema sebagaimana pendapat Sudjiman (1988:51) merupakan sebuah gagasan
yang mendasari karya sastra. Tema kadang-kadang di dukung oleh
pelukisan latar, dalam karya yang lain tersirat dalam lakukan tokoh,
atau dalam penokohan. Tema bahkan menjadi faktor yang mengikat
peristiwa-peristiwa dalam satu alur.
Tema sebagaimana pendapat-pendapat di atas merupakan pemikiran pusat
yang inklusif di dalam sebuah cerita (karya sastra). Kedudukannya
menyebar pada keseluruhan unsur-unsur signifikan karya sastra. Tema
tersebut ada yang dinyatakan dengan jelas, ada pula yang dinyatakan
secara simbolik atau tersembunyi (Scharbach, 1963:273). Aminuddin
(1987:92) merinci upaya pemahaman tema sebagai berikut:
– Memahami setting dalam prosa fiksi yang dibaca
– Memahami penokohan atau perwatakan para pelaku dalam prosa fiksi yang
dibaca.
– Memahami satuan peristiwa, pokok pikiran serta tahapan peristiwa dalam
prosa fiksi yang dibaca.
– Memahami plot atau alur cerita dalam prosa fiksi yang dibaca.
– Menghubungkan pokok pikiran-pokok pikiran yang satu dengan yang
lainnya yang disimpulkan dari satu-satuan peristiwa yang terpapar dalam
suatu cerita.
– Menentukan sikap penyair terhadap pokok pikiran yang ditampilkan.
– Mengidentifikasikan tujuan pengarang memaparkan ceritanya dengan
bertolak dari satuan pokok pikiran serta sikap penyair terhadap pokok
pikiran yang ditampilkannya.
– Menafsirkan tema dalam cerita yang dibaca serta menyimpulkannya dalam
satu dua kalimat yang diharapkan merupakan ide dasar cerita yang
dipaparkan.
Selain upaya pemahaman tema seperti di atas, untuk memahami tema,
seorang pembaca atau paresiator perlu juga memahami latar belakang
kehidupan yang diungkapkan pengarang lewat prosa fiksi yang merupakan
usaha pengarang dalam memahami keseluruhan masalah kehidupan yang
berhubungan dengan keberadaan seorang individu maupun dalam hubungan
antara individu dengan kelompok masyarakatnya.
D. Unsur Ekstrinsik Cerpen atau novel
Unsur ekstrinsik merupakan unsur dari luar yang turut mempengaruhi
terciptanya karya sastra. Unsur ekstrinsik meliputi biografi pengarang,
keadaan masyarakat saat karya itu dibuat, serta sejarah perkembangan
karya sastra. Melalui sebuah karya novel kita kadang secara jelas dapat
memperoleh sedikit gambaran tentang biografi pengarangnya. Melalui
sebuah novel kita pun dapat memperoleh gambaran tentang budaya dan
keadaan masyarakat tertentu saat karya itu dibuat.
Nilai-nilai dalam karya sastra dapat ditemukan melalui unsur ekstrinsik
ini. Seringkali dari tema yang sama didapat nilai yang berbeda,
tergantung pada unsur ekstrinsik yang menonjol. Misalnya, dua novel
sama-sama bertemakan cinta, namun kedua novel menawarkan nilai yang
berbeda karena ditulis oleh dua pengarang yang berbeda dalam memandang
dan menyingkap cinta, latar belakang pengarang yang berbeda, situasi
sosial yang berbeda,dan sebagainya.
Nilai-nilai yang terkandung
a. Nilai social masyarakat, sifat yang suka memperhatikan kepentingan
umum (menolong, menderma, dan lain-lain).
b. Nilai budaya Nilai yang berkaitan dengan pikiran, akal budi,
kepercayaan, kesenian, dan adat istiadat suatu tempat yang menjadi
kebiasaan dan sulit diubah.
c. Nilai ekonomi Nilai yang berkaitan dengan pemanfaatan dan asas-asas
produksi, distribusi, pemakaian barang, dan kekayaan (keuangan, tenaga,
waktu, industri, dan perdagangan).
d. Nilai filsafat, hakikat segala yang ada, sebab, asal, dan hukumnya.
e. Nilai politik, Nilai yang berkaitan dengan proses mental, baik normal
maupun abnormal dan pengaruhnya pada perilaku.
f. Nilai moral (nilai etik) adalah nilai untuk manusia sebagai pribadi
yang utuh, misalnya kejujuran; nilai yang berhubungan dengan akhlak;
nilai yang berkaitan dengan benar dan salah yang dianut oleh golongan
atau masyarakat.
g. Nilai keagamaan adalah konsep mengenai penghargaan tinggi yang
diberikan oleh warga masyarakat pada beberapa masalah pokok dalam
kehidupan keagamaan yang bersifat suci sehingga menjadikan pedoman bagi
tingkah laku warga masyarakat bersangkutan. pandangan pengarang itu
diakui sebagai nilai-nilai kebenaran olehnya dan ingin disampaikan
kepada pembaca melalui karya sastra.
Nilai moral dan nilai keagamaan tidak dapat dipisahkan satu dengan yang
lainnya. Pandangan hidup yang berhubungan dengan moral itu bersumber
dari nilai keagamaan. Seseorang bisa dikatakan orang bermoral, karena
orang itu beragama. Moral lebih dekat hubungannya antara manusia dengan
manusia, sedangkan agama hubungannya antara manusia dengan Tuhan.
E. Menulis Cerita Pendek Atau Novel
Pernahkah kamu menulis sebuah cerita pendek? Dalam Kamus Besar Bahasa
Indonesia (Depdikbud, 1997:186-187), cerita pendek adalah karya sastra
yang berupa kisahan pendek (kurang dari 10.000 kata) yang memberikan
kesan tunggal yang dminan dan memusatkan diri pada satu tokoh dalam
satu situasi (pada suatu ketika).
Berdasarkan pengertian di atas, cerita pendek mengisahkan kehidupan sang
tokoh yang berada dalam satu peristiwa atau satu kejadian. Tokoh yang
dikisahkan dapat berupa tokoh imajinatif atau tokoh nyata yang dekat
dengan kehidupan pengarangnya.
Perhatikan langkah-langkah menulis cerita pendek berikut ini!
1. Tentukanlah tokoh cerita yang akan dikisahkan!
Penentuan tokoh yang akan dipilih tentu tidak sulit karena selama
hidupmu biasanya ada teman-teman teordekat yang biasa menjadi tempat
mengadu, berdialog, tukar pikiran, minta saran, atau mendengarkan keluh
kesah hidup dan cintanya.
Untuk itu, sebagai bahan penulisan cerita pendek ini, kamu tinggal pilih
kisah siapakah yang akan diceritakan. Atau, mungkin kamu pernah
mendengar kisah tragis kehidupan seorang tokoh terkenal. Atau mungkin
pula tokohoperaih prestasi lah raga dunia. Yang terpenting, tokoh yang
akan kamu ceritakan, peristiwa yang terjadi, tempat dan waktu kejadian,
dan orang-orang yang terlibat di dalamnya betul-betul kamu ketahui.
Berdasarkan fungsinya, tokoh cerita dapat dibedakan atas tokoh sentral
dan tokoh bawahan (Sudjiman, 1992: 17). Tokoh yang memegangoperan
pimpinan disebut tokoh utama atau prtagnis. Tokoh ini menjadi tokoh
sentral dalam cerita. Kriteria tokoh utama bukan frekuensi
kemunculannya, melainkan berdasarkan intensitas keterlibatannya dalam
peristiwa yang membangun cerita.
Selain tokoh prtagnis, ada tokoh sentral yang termasuk tokoh utama yang
disebut tokoh antagnis yaitu tokoh yang merupakan penentang atau lawan.
Tokoh prtagnis mempunyai karakter baik dan terpuji, sedangkan tokoh
antagnis mempunyai karakter yang jahat atau salah.
Yang dimaksud dengan tokoh bawahan adalah tokoh yang tidak sentral
karena kehadirannya hanya untuk menunjang atau mendukung tokoh utama.
Untuk kepentingan penulisan cerita pendek yang kamu susun, tentukanlah
tokoh-tokoh cerita tersebut termasuk karakter penokohannya.
2. Urutkan alur cerita berdasarkan urutan peristiwa sesuai dengan waktu
dan tempat kejadian!
Tuliskan peristiwa yang akan dikisahkan. Urutkan peristiwa yang akan
dikisahkan berdasarkan urutan waktu atau urutan kejadian. Setelah
tergambar peristiwa yang akan dikisahkan, kamu dapat mengembangkan alur
ceritanya dari awal hingga akhir kejadian (alur maju). Atau sebaliknya,
kamu dapat mengawali cerita dari kejadian terakhir baru kamu uraikan
kejadian-kejaian sebelumnya (alur mundur/flashback). Atau, kamu dapat
menguraikan kejadiannya dengan cara gabungan dari setiap peristiwa
karena peristiwa yang satu berkaitan erat dengan kejadian yang lainnya
(alur gabung).
Setelah itu kamu tinggal menentukan, alur cerita mana yang akan kamu
tentukan agar cerita ini lebih menarik. Faktor latar cerita
memegangoperanan penting, tentu peristiwa yang dikisahkan sangat
berkaitan dengan waktu dan tempat. Untuk itu, identifikasi setiap
peristiwa yang dikisahkan dengan waktu dan tempat kejadiannya.
3. Kembangkanlah ide-ide cerita yang sudah kamu identifikasi tadi ke
dalam bentuk cerpen dengan memerhatikan teknik penceritaan yang menarik!
Menurut Sudjiman (1992: 91-101), terdapat beberapa teknik penceritaan
yaitu teknik pemandangan (panoramic/pictrial technique), teknik adegan
(scenic technique), teknik montase, teknik kolase, dan teknik asosiasi.
Teknik pemandangan umumnya lebih jelas dan terinci memberitahukan
waktu dan tempat cerita, serta membangun konteks tindakan dan kejadian
yang dikisahkan.
contoh teknik pemandangan
Mereka berhenti di depan meja-meja penuh makanan. Ekspresi Chelsea
berubah serius. Tatapannya melembut, srt matanya hangat dan penuh
simpati. Itulah yang disukai Jake pada diri Chelsea. Cewek itu baik
hati. Ia bukannya cuma ingin menunjukkan padamu seberapa hebatnya dia
dibandingkan dirimu.
Teknik adegan umumnya menyajikan cerita dengan menyajikan adegan
atau peristiwa dengan latar fisik yang jelas. Pembaca akan merasakan
bahwa dia terlibat dalam cerita dan peristiwa yang dikisahkan.
contoh teknik adegan
”Aku tahu” Rita balas berbisik. tapi kita kan sudah di sini, jadi
sekalian saja kita Lihat-lihat. Diguncangkannya senternya, berharap
sinarnya bisa lebih terang. Rambut Rita yang hitam jatuh di matanya. Ia
menyibakkannya dan bergerak lebih dekat kepada Roni.
Teknik montase yakni teknik penceritaan dengan cara memotong-motong
cerita sehingga akan menghasilkan cerita yang terputus-putus. Pembaca,
kadang-kadang merasa pusing atas kekacauan cerita yang tidak logis dan
sistematis yang memang disengaja oleh penceritanya.
Contoh Teknik Montase
Emry tak pemah bicara dengan suara pelan ia cuma bisa bicara dengan
suara keras, selah-lah berada di panggung opera. Dengan rambut hitam
berantakannya yang tak pernah tersentuh oleh sisir, dan suaranya yang
dalam dan menggelegar, ke mana pun emry pergi, ia selalu menarik
perhatian. Berpikirnya cepat. Bicaranya cepat. Ia tak pemah berjalan,
ia selalu berlari. Ia selalu tampak terburu-buru, ia selalu melakukan
enam hal sekaligus, memberi instruksi pada selusin orang, bicara cepat
dan pada saat yang sama membuat catatan kecil ”kayaknya sih nggak ada,
orang jake”. Diangkatnya setengah potong sandwich ayam dan dijatuhkannya
ke piring kertasnya. Ia berpikir keras. ”Yah…Aku bisa nntn gratis. Itu
lumayan asyik” ia mengakui. ”Tapi hampir semua anak di sekolah kita
juga, bisa nonton gratis,”
jake menambahkan. “adi kurasa itu nggak ada artinya.”
Teknik kolase adalah teknik penyajian cerita yang sarat dengan
kutipan dari karya sastra yang lain. Kadang-kadang cerita
terpotong-potong dan tidak berhubungan karena adanya penempelan kutipan
karya lain. Teknik asosiasi adalah teknik penceritaan dengan cara
mengasosiasikan dengan hal lain yang bertautan atau berhubungan.
Asosiasi dapat terbentuk dalam diri tokoh, pembaca, atau pencerita.
contoh teknik kolase
Jake tahu ada yang tidak beres begitu ia dan ayahnya memasuki kelas.
Tubuh emry langsung kaku. Ia menurunkan pandangannya. Matanya menyapu
ruangan yang terang benderang itu. Suara desisan yang mendirikan bulu
kuduk muncul dari bagian depan kelas. ”Sheila?” Seru Emry seraya
menghentikan langkah di depan pintu. ”di mana para kru?” Jake berjalan
pelan ke sisi Emry dan memandang isi ruangan. Ia tidak melihat Sheila.
Ia tidak melihat satu pun kru di sana.
Teknik asosiasi adalah teknik penceritaan dengan cara mengasosiasikan
dengan hal lain yang bertautan/berhubungan. Asosiasi dapat terbentuk
dalam diri tokoh, pembaca, atau pencerita.
contoh teknik asosiasi
Apa tidak mungkin ia berubah menjadi ular besar pada suatu waktu? Dan
jika terjadi demikian, pastilah pahlawan itu menggantung diri. Sebab ia
malu. Apa tidak mungkinoperawan itu telah menggantung diri? Telah habis
plisi mencari keteorangan. Tapi jawab tetangga selalu tidak tahu.
Berdasarakan teknik penceritaan yang telah diuraikan di atas, kamu dapat
memilih teknik mana yang akan dipilih untuk mengembangkan ide cerita
pendek yang akan ditulis. Kamu dapat menggunakan ragam bahasa yang
menarik sesuai dengan tema cerita yang disampaikan.
F. Menyadur cerpen atau novel menjadi drama
Menyadur adalah menyusun kembali cerita secara bebas tanpa merusak garis
besar cerita (KBBI, 2001: 976). Cerpen terdiri atas paragraf-paragraf,
sedangkan drama terdiri atas adegan-adegan dan dialog.
Langkah-langkah menyadur drama adalah
1. Membaca cerpen tersebut dengan teliti
2. Mengenali unsur-unsur cerpen, kemudian mencatat unsur-unsur tersebut.
3. Menyempurnakan catatan dari awal sampai akhir.
Menyadur cerpen dapat dilakukan juga dengan cara memperluas unsur
intrinsik dan unsur-unsur lain yang mendukung cerpen misalnya:
1. menambah tokoh
2. mengembangkan penokohan
3. menghidupkan konflik
4. menghadirkan latar yang mendukung
5. memunculkan penampilan (performance)
Sebelum Anda menyadur cerpen menjadi drama pahamilah bagian-bagian drama
berikut ini:
1. pengenalan
2. pemunculan peristiwa atau masalah
3. situasi menjadi rumit atau masalah menjadi kompleks
4. masalah/persoalan mencapai klimaks/titik kritis
5. situasi surut dan penyelesaiannya
G. Definisi Hikayat
Dick Hartoko dan B. Rahmanto (1985:59) mengatakan bahwa hikayat adalah
jenis prosa, cerita Melayu Lama yang mengisahkan kebesaran dan
kepahlawanan orang orang suci di sekitar istana dengan segala kesaktian,
keanehan, dan mirip cerita sejarah atau membentuk riwayat hidup.
Contoh:
- Hikayat Indera Bangsawan;
- Hikayat Iskandar Zulkarnaen;
- Hikayat Bayan Budiman
Hikayat merupakan bentuk cerita yang berasal dari Arab. Mulai dikenal di
Indonesia sejak masuknya ajaran Islam ke Indonesia. Hikayat itu hampir
mirip dengan dongeng, penuh dengan daya fantasi. Biasanya berisi cerita
kehidupan seputar istana. Kisah cerita anak-anak raja, pertempuran
antarnegara, seorang pahlawan yang memiliki senjata sakti, dan
sebagainya. Hikayat sering kali disebut sebagai dongeng istana. Tokoh
dalam hikayat sudah dapat dipastikan raja, permaisuri, putra dan putri
raja, juga para kerabat raja. Cerita terjadi di negeri Antah Berantah,
dan selalu berakhir dengan kemenangan tokoh yang selalu berpihak pada
hal yang benar.
Hikayat adalah karya sastra lama Melayu yang berbentuk prosa yang berisi
cerita, undang-undang, dan silsilah bersifat rekaan, keagamaan,
historis, biografis, atau gabungan atau sekadar untuk meramaikan pesta.
Misalnya: Hikayat Hang Tuah, Hikayat Seribu Satu Malam
1. Ciri-ciri hikayat
a Sebagian besar berupa sastra lisan (disampaikan dari mulut kemulut);
b Anonim (tidak dikenal nama pengarangnya);
c Komunal (hasil sastra yang ada dianggap milik bersama);
d Statis (tidak mengalami perubahan atau perkembangan);
e Tidak berangka tahun (tidak diketahui secara pasti kapan karya
tersebut dibuat); dan
f Istana sentris/kraton sentries kehidupan raja-raja dan kaum
kerabatnya).
2. Ciri khas sebuah hikayat:
a Menimba bahannya dari kehidupan raja-raja dan dewa-dewi,
b Isinya dongeng yang serba indah yang membawa pikiran sifat-sifat itu,
dibaca untuk pelipur
c Pembaca ke alam khayal, dan lara, pembangkit semangat juang,
d Melukiskan peperangan yang hebat, dahsyat, tempat para raja/dewa
mempertunjukkan kesaktiannya untuk merebut kerajaan atau seorang puteri.
e Dalam hikayat biasanya tak ketinggalan dilukiskan peperangan yang
menunjukkan bentuk kesaktiannya rajaan atau seorang putri.
H. Perbedaan Hikayat dengan Novel
Novel adalah karangan prosa yang panjang mengandung rangkaian cerita
kehidupan seseorang dengan orang di sekelilingnya dengan menonjolkan
watak dan sifat setiap pelaku.
Istilah novel berasal dari bahasa Italia novella yang berarti kabar atau
berita. Adapun ciri khas sebuah novel di antaranya: di dalam sebuah
novel terdapat konflik yang mengakibatkan perubahan nasib pada pelakunya
menceritakan satu segi kehidupan pelaku jalan ceritanya singkat; hanya
mengenai hal-hal yang pokok/garis besarnya
Hikayat dan novel keduanya merupakan bentuk karya sastra yang berupa
prosa. Bedanya, hikayat merupakan bagian dari prosa lama sedangkan novel
bagian dari prosa baru.
Dalam perkembangannya, kini kita lebih mengenal bentuk novel daripada
hikayat. Hikayat merupakan peninggalan sastra Melayu. sementara novel
bagian dari perkembangan hasil karya sastra Indonesia. Kini kita banyak
mengenal hasil karya novel populer maupun novel yang tergolong karya
sastra. Bahkan novel terjemahan dari berbagai negara pun banyak
diterbitkan di Indonesia.
8. TIK
A. Cara Memasang Widget Jam dan Tanggal di Blog Dengan JavaScript |
Kalu biasanya sih pasang jam di blog menggunakan widget dari pihak ke-3
seperti clocklink, clockwidget dll yang kadang kurang simple, makan
tempat juga bikin blog berat *maybe*. Tapi gw mau share
cara pasang
widget jam dan tanggal di blog menggunakan javascript yang lumayan
ringan dan simple.
Sejak artikel terakhir tentang
Review Film The Raid Redemption
(yang filmnya terus naik peringkatnya di box office) kemaren, gw pusing
mau posting apa (yah, ini blogger newbie yang selalu kehabisan sabun
#eh) sampai kemudian tibalah saatnya #jengjeng muncul ide posting widget
jam yang udah lama gw pakai di blog ini *dulu* dan di blog
afika.
Simple dan
kurang menarik sih tapi aja juga yang minat
muehehehe...
Kode aslinya didapat dari
javascriptkit kemudian gw otak-atik
dan ubah dikit agar sesuai dengan keinginan :p, oia kalau temen-temen
mau belajar js, css, html disana juga bisa :). Ok langsung aja ini
scriptnya
Nah, setelah dapet kodenya mau diletakkan mana? Kalau gw yang newbie sih
pilih cara gampang aja tinggal add widget >HTML/Javascript paste
save, liat hasilnya.
Oia kalau cuma jam aja kurang lengkap sepertinya, hmmm gw tambahin sama
hari, tanggal dan tahun pasti lebih manis tampilannya :D. Langsung ini
codenya
Masalah dimana diletakkan itu terserah sobat, kalau gw sih di campur
atau di gabungin sama widget jam diatas biar manis seperti tampilan
dibawah ini...
Sekian postingan singkat gw tentang
Cara Memasang Widget Jam dan Tanggal di
Blog Dengan JavaScript semoga bermanfaat :),
Sekarang kita buat entri atau posting
anda di blog.





 maka
maka

 maka
maka

 maka
maka


 maka
maka

 maka
maka


















 Mengenal sistem pernapasan merupakan salah satu
bentuk upaya kita mengenal lebih dalam salah satu proses penting dalam
tubuh.
Mengenal sistem pernapasan merupakan salah satu
bentuk upaya kita mengenal lebih dalam salah satu proses penting dalam
tubuh. 
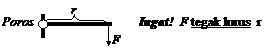
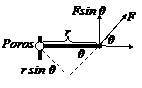
 ) pun
"keseimbangan" menduduki salah satu posisi tertinggi diantara
kaidah-kaidah yang ada. Yang dimaksud "keseimbangan" disini dalam banyak
kasus justru tidak sekedar memperlihatkan adanya perimbangan dari dua
hal saja. Keseimbangan dalam Tao memiliki arti yang demikian dalam dan
luas, berkaitan erat dengan konsep "kealamiahan".
) pun
"keseimbangan" menduduki salah satu posisi tertinggi diantara
kaidah-kaidah yang ada. Yang dimaksud "keseimbangan" disini dalam banyak
kasus justru tidak sekedar memperlihatkan adanya perimbangan dari dua
hal saja. Keseimbangan dalam Tao memiliki arti yang demikian dalam dan
luas, berkaitan erat dengan konsep "kealamiahan". ). Karena
penerapannya yang juga demikian luas maka konsep keseimbangan praktis
akan dibahas secara umum saja dan lebih banyak mengarah pada fungsi dan
peranan sosial kita, dimulai dari skala terkecil yaitu diri kita
sendiri.
). Karena
penerapannya yang juga demikian luas maka konsep keseimbangan praktis
akan dibahas secara umum saja dan lebih banyak mengarah pada fungsi dan
peranan sosial kita, dimulai dari skala terkecil yaitu diri kita
sendiri.












































0 komentar:
Posting Komentar